Основы - Почвенная вода: от молекулярной структуры к поведению
Авторы: Owen W.
Duckworth (Факультет почвоведения Университета штата Северная Каролина), Joshua L. Heitman (Факультет почвоведения Университета
штата Северная Каролина) и Matthew L.
Polizzotto (факультет почвоведения Университета штата Северная
Каролина)
© 2014 Nature Education
Ссылка: Duckworth, O. W.,
Heitman, J. L. и Polizzott, M. L. (2014) Почвенная вода: от
молекулярной структуры к поведению. Знание о природе 5 (8): 1
Вода —
уникальное соединение, необходимое для жизни на Земле. В педосфере физические и
химические свойства воды регулируют поток энергии и растворенных веществ, что
делает почвенную воду важнейшим компонентом наземных экосистем. Многие
известные свойства воды, которые определяют ее поведение в почве, могут быть
напрямую связаны с ее молекулярной структурой.

«Вода — движущая сила всей природы». - Леонардо да Винчи
Вода является вездесущим и критически
важным веществом на Земле. Необходимая для всех живых существ и здоровья
экосистем (Moss 2010), вода считается предпосылкой для жизни на других планетах
(Marais и друг 2008). Доступность воды даже частично контролирует развитие и
распространение населенных пунктов (Solomon, 2011). Поскольку численность
населения продолжает расти, обеспечение человечества чистой водой для бытовых,
сельскохозяйственных и промышленных нужд считается одной из основных социальных
проблем 21 века (Национальная инженерная академия, 2008 г). В почвах вода является основным двигателем
биогеохимических процессов (рис. 1). Химические реакции, контролирующие
почвообразование, и реакции выветривания происходят почти исключительно в
жидкой воде (Lindsay 1979). Физически вода является диффузионной средой,
которая обеспечивает движение газов, растворенных веществ и частиц в почвах. Вода
регулирует передачу тепла, тем самым способствуя сохранению температуры почвы
(Jury & Horton 2004).
Биологически
микробам для метаболического функционирования требуется вода в порах почвы
(Maier и друг. 2008). Кроме того, наличие воды считается одним из наиболее
важных факторов для роста сельскохозяйственных культур и других растений
(Kirkham 2005). В этой статье мы исследуем, как молекулярная структура,
химические и физические свойства воды контролируют функционирование почв.
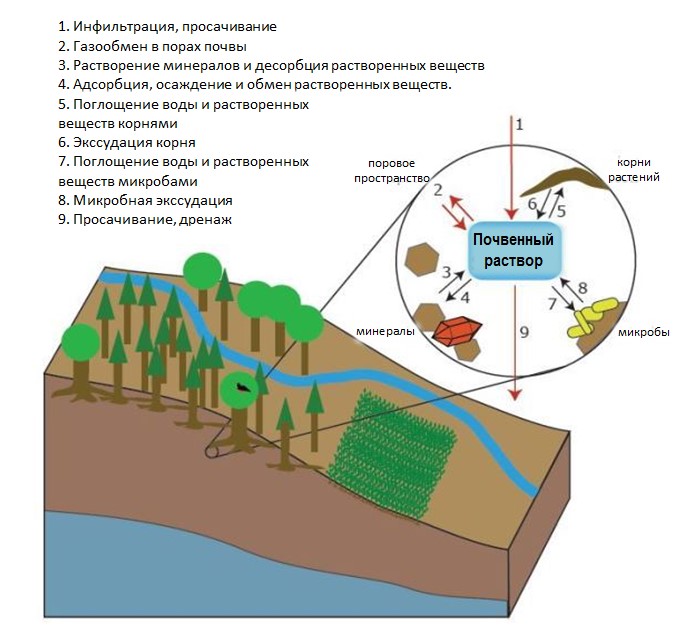
Рисунок 1: Схема, показывающая основные процессы,
связанные с водой в почвах.
Красные стрелки указывают на преимущественно физические
процессы, тогда как черные стрелки указывают на преимущественно геохимические
процессы. Для получения дополнительной информации о процессах 1 и 9 см. O'Geen
(2013); о процессах 3 и 4 см. Thompson and Goyne (2012); для процессов 5-8 см.
McNear (2013) и Fortuna (2012).
© 2014 Nature Education По материалам Lindsay (1979). Все права
защищены.
Молекулярная структура воды
Молекулярные
свойства воды обуславливают многие из ее уникальных и привычных (обычных) качеств.
По отдельности молекулы воды состоят из двух атомов водорода, присоединенных
ковалентными связями к тетраэдрическому атому кислорода (рис. 2А), в результате
чего молекула изогнута с углом 104º между атомами водорода. Поскольку на атоме
кислорода находятся две электронные пары (с дополнительной электронной парой,
общей для кислорода и каждого атома водорода), молекула имеет постоянный
дипольный момент с положительным зарядом (δ+), находящимся на атоме водорода, и
отрицательным зарядом ( δ-) на атоме кислорода (Pauling, 1988). Водородные связи,
возникающие в результате электростатических взаимодействий между более
положительными атомами водорода и более отрицательными атомами кислорода в
соседних молекулах, представляют собой относительно сильные межмолекулярные
силы. Эти взаимодействия ответственны за кооперативный характер (природу) воды,
то есть молекулам воды более выгодно быть окруженными другими молекулами воды
большими группами, чем существовать в виде отдельных молекул или димеров
(Franks 2000). Напротив, неполярные молекулы, которые имеют примерно ту же
молекулярную массу, что и вода, обычно представляют собой газы, которые слабо
взаимодействуют друг с другом при комнатной температуре (Pauling, 1988). Хотя существует множество моделей, описывающих поведение жидкой воды (Eisenberg
и
Kauzmann 1969, Frank 1972, Ives и Lemon
1968), в широком смысле ее можно представить как динамические кластеры (скопления) кувыркающихся
молекул, связанных водородными связями (рис. 2В). При замерзании вода образует
кристаллическое твердое вещество с молекулами, расположенными в виде
тетраэдров, что приводит к расширению твердой фазы (рис. 2, с).
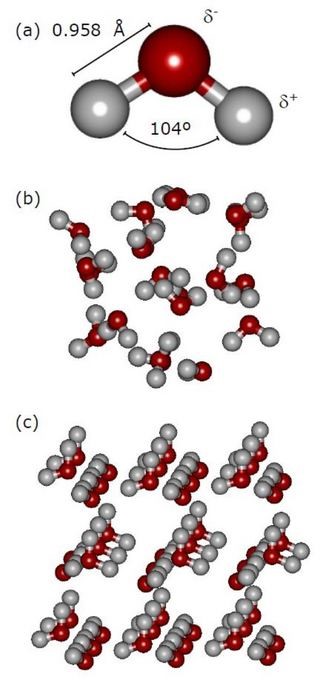
Рисунок 2: Структура воды.
Панель (группа) (а) Одна молекула воды. δ+ и δ-
указывают на частичные положительные и отрицательные заряды молекулы, связанные
с ее дипольным моментом. Панель (группа) (b) Скопление молекул воды. Панель (группа) (c) Структура льда.
© Nature Education 2014 г. Панель (группа) (а) адаптировано
из материалов James и
друг., 2005. Панель
(группа) (b)
адаптирована из Wales и друг.
2013. Панель (группа) (c)
адаптирована из Fortes и друг. 2004. Все права защищены.
Вода
обладает многими аномальными физическими и химическими свойствами,
обусловленными ее молекулярной структурой (табл. 1). Полярная природа молекулы
помогает объяснить ее высокую диэлектрическую проницаемость и ее ионную
диссоциацию, что приводит к ее способности разделять заряды на ионы и
растворять полярные твердые вещества. Когезионный (связующий) характер,
возникающий из-за межмолекулярного притяжения молекул воды, приводит к
аномально высокому поверхностному натяжению, теплоемкости, теплоте
парообразования и температуре кипения. Упорядочивание молекул воды при
замерзании приводит к высокой теплоте плавления и уменьшению плотности твердой
фазы. Как показано в таблице 1, эти свойства имеют решающее значение для
понимания химии и физики воды в почвах.
|
Свойство |
Молекулярное обоснование |
Значение |
|
Высокая
диэлектрическая проницаемость |
Дипольный момент
позволяет воде стабилизировать растворенные вещества как с положительным, так
и с отрицательным зарядом. |
Отличный
растворитель для полярных и заряженных частиц |
|
Ионная
диссоциация |
Вода легко
распадается на протоны и гидроксид-ионы из-за полярности молекулы. |
Кислотно-основная
химия водных растворов облегчается этим свойством. |
|
Расширение при
замерзании |
Упорядочивание
молекул в кристаллическом твердом теле приводит к большему объему пустот, чем
в жидкой фазе. |
Лед плывет;
замерзание происходит в верхней части водного тела |
|
Высокая
температура кипения |
Адгезия молекул
препятствует переходу в газовую фазу |
Вода является
жидкостью при обычных температурах |
|
Высокая
теплоемкость |
Сильные
взаимодействия между молекулами требуют большого энергетического вклада для
изменения температуры. |
Температура
защищена от небольших изменений тепловой энергии |
|
Высокая теплота
парообразования |
Адгезия молекул
требует большого подвода тепла, чтобы вызвать переход в газовую фазу. |
Температура
дополнительно буферизуется при экстремальных температурах окружающей среды |
|
Высокая теплота
плавления |
Упорядочивание
молекул при замораживании приводит к значительному выделению тепловой
энергии. |
Температура
дополнительно буферизуется при экстремальных температурах окружающей среды |
|
Высокое
поверхностное натяжение |
Молекулы имеют
кооперативные взаимодействия, которые вызывают сцепление на поверхностях
контакта. |
Вызывает
образование капель и капиллярное поведение |
|
Таблица 1: Важные свойства воды и их связь с ее молекулярной
структурой. Адаптировано из Manahan (2004) и Pierzynski и друг. (2005). |
||
Химические свойства воды и поведение в почвах
Химические
свойства воды определяют ее поведение в окружающей среде и контролируют многие
ключевые процессы, происходящие в почвах при взаимодействии водной фазы с
организмами, минеральными поверхностями и воздушными пространствами. В
результате своей нелинейной структуры и дипольного момента (рис. 2А) вода имеет
высокую диэлектрическую проницаемость (80,1 при 20°С) (Eisenberg и Kauzmann,
1969, Hasted, 1972), что является мерой способности вещества минимизировать силу
притяжения между противоположно заряженными видами. Диэлектрическая
проницаемость воды, которая значительно выше, чем у твердых и газообразных
компонентов почвы (диэлектрическая проницаемость ~ 2-5 и 1 соответственно),
часто используется в методах электромагнитных измерений для определения
влажности почвы. Это уникальное свойство воды также делает ее мощным растворителем,
позволяющим легко растворять ионные твердые вещества. Вода рассеивает силу
притяжения ионов, образуя сольватационные сферы (рис. 3) вокруг них (Burgess, 1978, Essington,
2004, Franks, 2000). Полярная природа молекул воды позволяет им окружать и
стабилизировать заряды как анионов, так и катионов (Pauling, 1988), предотвращая их
ассоциацию.
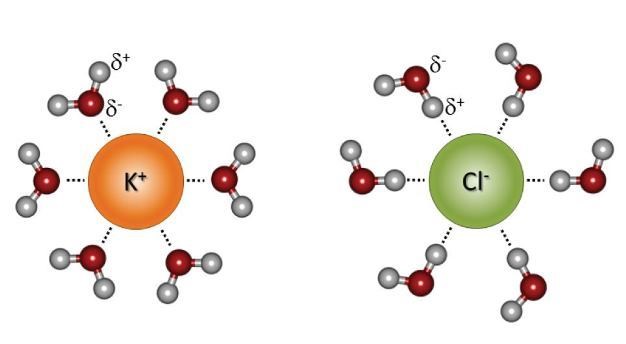
Рисунок 3: Сольватационные сферы.
Вода образует сольватационные сферы
вокруг ионов в растворе, при этом отрицательный заряд атома кислорода
выравнивается с положительно заряженными катионами, а положительный заряд
атомов водорода выравнивается с отрицательно заряженными анионами.
© 2014 Nature Education Все права защищены.
Рассмотрим растворение хлорида калия (KCl), распространенного источника калия в химических удобрениях (Havlin и друг. 2005). При соединении с водой ионное твердое вещество растворяется:
KCl(s)+(m+n)H2O(l)↔[K(H2O)m]+(aq)+[Cl(H2O)n]-(aq)
где m и n представляют количество молекул воды в каждой сольватационной сфере — числа, которые зависят от заряда, размера, концентрации и химических свойств ионов в растворе (Burgess, 1978). Хотя KCl хорошо растворим и легко растворяется, степень растворения или осаждения других почвенных минералов варьируется в зависимости от конкретных свойств минералов и химического состава почвенного раствора (Essington 2004). Способность воды усиливать растворение или предотвращать выпадение осадков влияет на целый ряд процессов и свойств почв, включая выветривание минералов, засоление и плодородие почвы (Brantley 2008, Havlin и друг 2005). Еще одним особенно важным химическим свойством воды, влияющим на процессы, происходящие в почвенном растворе, является ее амфотерность, то есть она может действовать как кислота или как основание (IUPAC 1997). Из-за своей полярности вода легко подвергается ионной диссоциации на протоны и гидроксид-ионы (Eisenberg и Kauzmann 1969, Pauling 1988):
H2O(l) ↔ H+(aq) + OH-(aq) (1)
Соответственно, при реакции с сильным основанием вода действует как кислота, высвобождая протоны:
H2O(l) + NH3 ↔ NH4+(aq) + OH-(aq) (2)
При взаимодействии с сильной кислотой вода действует как основание, принимая протоны:
H2O(l) + HCl ↔ H3O+(aq) + Cl-(aq) (3)
Амфотерное поведение воды
способствует кислотно-основной химии и диктует потенциальный диапазон pH водных
растворов, тем самым придавая pH почвы — «главную переменную» почв, которая
влияет на формирование почвы, рост растений и качество окружающей среды (Sparks
2003). Способность воды стабилизировать заряженные частицы в растворе позволяет
ей поддерживать поток электронов в почве. Таким образом, вода способствует
окислительно-восстановительным (редокс) реакциям в почвенном растворе.
В этих процессах может участвовать и сама вода (Франк, 1972), являющаяся продуктом клеточного дыхания почв. В аэробных почвах вода образуется в результате окисления углерода в органическом веществе (обозначенном здесь как CH2O) для производства энергии микроорганизмами:
CH2O(s) + O2(g) → CO2(g) + H2O(l) (4)
В приведенной выше реакции перенос электронов снижает степень окисления кислорода в O2 (0) до степени окисления воды (-2). В частности, в анаэробных почвах окисление углерода также может быть связано с восстановлением химических соединений, отличных от O2. Конкретные процессы дыхания в почвах регулируются термодинамикой и кинетикой реакций, но происходят в почвенном растворе или на границе раздела минералов и раствора (Sposito 2008, Stumm и Morgan 1996). Это важные процессы, которые регулируют структуру микробного сообщества, минералогию почвы, химический состав почвенного раствора, удел и перенос загрязняющих веществ (Lovley 1995, Sparks 2003).
Физические свойства воды и поведение в почвах
Жидкая вода является ключевым компонентом трехфазной (твердая,
жидкая, газообразная) почвенной системы, которая может занимать 50% или более
общего объема почвы в условиях насыщения (Hillel 1998; Рисунок 4).
Даже в относительно сухих условиях вода, удерживаемая в почвенных порах под большим напряжением, занимает примерно 5–10% объема почвы (Campbell и Norman 1998). Жидкая вода удерживается в почве под действием сил адгезии и когезии (связующих), связанных с молекулярной структурой воды (Jury и Horton 2004). Способность воды удерживаться в почвенных порах за счет когезии и адгезии частично контролирует накопление и перераспределение воды в гидрологическом цикле (O'Geen 2013).
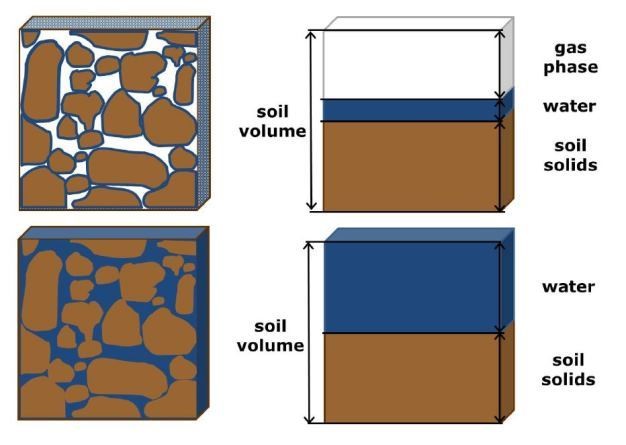
Рисунок 4: Насыщенные и ненасыщенные почвенные условия.
Объемные фракции твердой, водной и газовой фаз в
почве для ненасыщенных (вверху) и насыщенных условий (внизу).
© 2014 Nature Education Все права защищены.
Взаимодействие между водой и твердой матрицей почвы часто визуализируют с помощью модели капиллярной трубки (рис. 5). Жидкая вода на границе раздела вода-газ имеет мениск. Внутреннее притяжение молекул жидкой воды из-за водородных связей (когезии) неуравновешено на границе раздела жидкости и газа, что называется поверхностным натяжением.
В сочетании с полярным притяжением молекул воды к твердой матрице
смачиваемой почвы (адгезия к стенке капиллярной трубки) эта связь (когезия) создает
вогнутую кривизну. Вода поднимается в трубке, чтобы достичь равновесия между
восходящей силой притяжения на границе раздела и весом воды, притягивающей
мениск вниз.
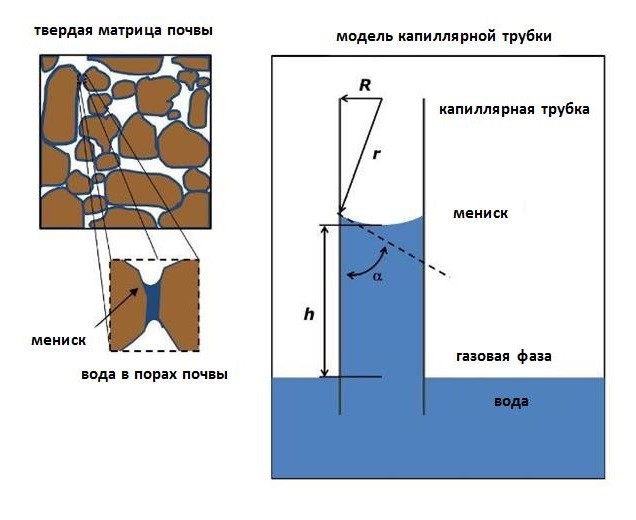
Рисунок 5: Модель капиллярной трубки.
Вода в порах почвы (слева) и аналог модели капиллярной
трубки (справа), определяемый диаметром трубки (R), радиусом кривизны (r),
краевым углом (α) и высотой подъема (h).
© 2014 Nature Education Все права защищены.
Криволинейную границу между жидкостью и газом можно
описать характерным радиусом кривизны (r):
r = R/cos α (5)
где R — радиус капиллярной трубки, α
— контактный угол между границами раздела жидкость-твердое тело и жидкость-газ
(рис. 5). Для гидрофильных поверхностей, таких как кварц, составляющий большую
часть твердых частиц в минеральных почвах, обычно мало, так что cos α ≈ 1
(Brutsaert 2005). Для несмачиваемых поверхностей, таких как минералы, покрытые
гидрофобными органическими соединениями, α увеличивается, а r изменяется
(Bachmann и van Der Ploeg 2002).
Перепад давления (Δp) на границе
раздела жидкости и газа можно описать как:
Δp = 2σcosα/R (6)
где σ — поверхностное натяжение воды.
Равновесие достигается, когда вес водяного столба равен перепаду давления на
площади поперечного сечения границы раздела жидкости и газа (Jury и Horton, 2004).
Из этого равновесия высота подъема в
капиллярной трубке (h) определяется:
h = 2σcosα/Rρg (7)
где ρ - плотность воды, а g - ускорение свободного падения. Исходя из этого соотношения, h зависит от свойств воды, а также от геометрии твердой матрицы почвы. Почвенные поры относительно небольшого радиального размера, ведущие себя подобно капиллярным трубкам, допускают большую высоту подъема (h ∝ 1/R), т. е. вода в мелких порах удерживается при большем натяжении. Измерения количества воды, выделяемой из почвы при различных давлениях, использовались вместе с уравнением 7 для характеристики распределения пор почвы по размерам. Аналог капиллярной трубки для пор почвы также использовался для понимания увлажнения над уровнем вод (грунтовых) (например, в ненасыщенной зоне) и того, как методы управления, изменяющие распределение пор по размерам, такие как сельскохозяйственная обработка почвы, могут влиять на водоудерживающую способность почвы. Преобладание воды в почвенной системе также влияет на динамику земной (наземной) температуры (Campbell и Norman 1998). Когда жидкая вода попадает в матрицу почвы, она вытесняет газовую фазу почвы (рис. 4). Вода требует относительно больших затрат или потерь энергии (теплоемкость, 4,18 кДж кг-1 К-1) для изменения своей температуры из-за сильных взаимодействий (водородных связей) между диполярными молекулами воды. С другой стороны, слабые межмолекулярные взаимодействия в почвенных газах позволяют легко изменять температуру почвы с небольшим подводом или потерей энергии. Кроме того, поскольку почвенная вода может существовать в жидкой, газообразной (пар) и твердой (лед) фазах, скрытая потеря тепла или приток тепла от почвы, связанные с фазовым переходом, также влияют на тепловой режим (Campbell и Norman 1998). Во влажной среде с достаточным количеством почвенной влаги потеря водяного пара из почвы в результате испарения требует большого подвода энергии (теплота парообразования, 2449 кДж/кг) без сопутствующего изменения температуры из-за большого подвода энергии, необходимого для разрыва водородных связей между жидкими водными молекулами. (рис. 2В) Точно так же для промерзания грунта требуются большие потери скрытого тепла из-за высокой теплоты плавления (334 кДж кг-1), связанной с более жесткой структурой льда с низкой плотностью (рис. 2С). Термические свойства воды в почве опосредуют экологические условия для биологического сообщества и регулируют термодинамику биогеохимических реакций.
Сводки и выводы
Структура воды может напрямую объяснить уникальный набор меж- и внутримолекулярных сил, большинство из которых связано с дипольным моментом воды, что приводит к ряду знакомых свойств. Эти свойства имеют решающее значение для процессов выветривания, которые формируют почвы. Они регулируют потоки вещества и энергии, которые позволяют почве быть живой средой, поддерживающей множество живых организмов. Таким образом, почвенная вода является важнейшим ресурсом, который закладывает основу для здоровья и функционирования экосистемы. Поскольку человеческое население продолжает расти, понимание поведения и важности воды в почве будет становиться все более важным для эффективного использования почвы для удовлетворения растущих потребностей общества в пище, энергии и воде (Falkenmark и Rockström 2006, Sposito 2013).
Словарь
адгезивный: свойство вещества,
которое сильно взаимодействует с поверхностью других веществ
амфотерный: способность действовать
как кислота или основание
точка кипения: температура, при
которой жидкость превращается в газ
когезионный (связующий): свойство
вещества сильно взаимодействовать с другими молекулами того же вещества
кооперативный: свойство быть энергетически
более выгодным для молекул воды быть окруженными другими молекулами воды в
больших группах, чем существовать в виде отдельных молекул или димеров
ковалентная связь: химическая связь,
связанная с разделением электронов между атомами
диэлектрическая проницаемость: диэлектрическая проницаемость вещества,
выраженная как отношение к диэлектрической проницаемости свободного
пространства; высокая диэлектрическая проницаемость позволяет среде
стабилизировать заряженные частицы
димер: структура, состоящая из двух ассоциированных
идентичных субъединиц
диполь: разделение положительного и
отрицательного заряда на молекуле
растворение: фазовое изменение,
приводящее к превращению твердого вещества в растворенное вещество
теплоемкость: количество теплоты,
необходимое для изменения температуры вещества на заданную величину
теплота плавления: количество тепла,
которое должно быть поглощено или выделено для перехода вещества между жидкой и
твердой фазами.
теплота парообразования: количество
теплоты, которое должно быть поглощено или выделено для перехода вещества между
газообразной и жидкой фазами
водородная связь: межмолекулярное
электростатическое притяжение между полярными молекулами, при котором водород
взаимодействует с отрицательным полюсом молекулы; обычно этим полюсом является
атом кислорода, азота или галогена.
ионная диссоциация: реакция молекул
одного и того же вещества, в результате которой образуются ионы. Для воды это
реакция воды с образованием протонов и ионов гидроксида.
скрытая теплота: теплота, которая
поглощается или выделяется без изменения температуры; тепло, связанное с
переходом между твердой, жидкой и газообразной фазами
педосфера: внешний слой земной
поверхности, состоящий из почвы
окислительно-восстановительный
(редокс): класс химических реакций, связанных с переносом электронов (окисление
и восстановление)
pH почвы: мера кислотности почвы,
определяемая как отрицательный логарифм активности протонов (pH = - log[H+])
сольватационные сферы: молекулы воды,
находящиеся в непосредственном контакте с растворенными частицами; также
известные как сольватационные оболочки, гидратные оболочки или гидратационные
сферы
поверхностное натяжение: свойство,
связанное со сцеплением (когезией) похожих молекул на границе раздела жидкости
и газа, которое обеспечивает тенденцию к сжатию жидкости внутрь
тетраэдры: центральный атом,
связанный с четырьмя атомами, расположенными в вершинах пирамиды, состоящей из
равносторонних треугольников.
ненасыщенная зона: область над
уровнем грунтовых вод, содержащая как воду, так и воздух в поровом
пространстве.
уровень грунтовых вод: поверхность, на которой
давление воды в порах равно атмосферному давлению; ниже уровня грунтовых вод
поры заполнены водой